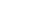解决方案
农用微生物菌剂(GB 20287-2006)
发布时间:2019-3-12 10:11:01
本标准的5.1、5.3和第8章条文为强制性条款,其余为推荐性条款。
本标准的附录A、附录C和附录D为规范性附录,附录B为资料性附录。
本标准规定了农用微生物菌剂(即微生物接种剂)的术语和定义、产品分类、要求、试验方法、检验规则、包装、标识、运输和贮存。
本标准适用于农用微生物菌剂类产品。
2 规范性引用文件(略)
3 术语和定义(略)
4 产品分类
产品按剂型可分为液体、粉剂、颗粒型;按内含的微生物种类或功能特性可分为根瘤菌菌剂、固氮菌菌剂、解磷类微生物菌剂、硅酸盐微生物菌剂、光合细菌菌剂、有机物料腐熟剂、促生菌剂、菌根菌剂、生物修复菌剂等。
5 要求
5.1 菌种
生产用的微生物菌种应安全、有效。生产者应提供菌种的分类鉴定报告,包括属及种的学名、形态、生理生化特性及鉴定依据等完整资料。生产者应提供菌种安全性评价资料。采用生物工程菌,应具有允许大面积释放的生物安全性有关批文。
5.2 产品外观(略)
5.3 产品技术指标
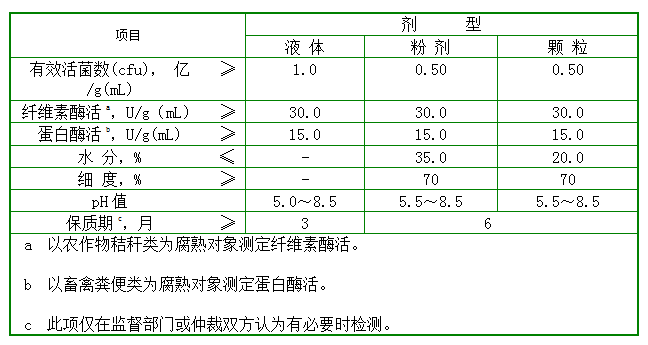
5.3.1 农用微生物菌剂产品的技术指标见表1,其中有机物料腐熟剂产品的技术指标按表2执行。
表1 农用微生物菌剂产品的技术指标
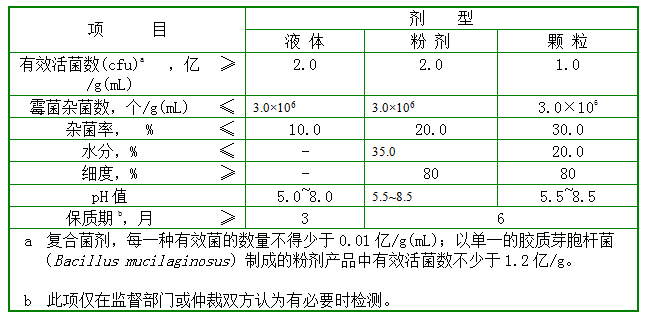
表2 有机物料腐熟剂产品的技术指标
5.3.2 农用微生物菌剂产品中无害化指标见表3。

6 试验方法
6.1 仪器设备(略)
6.2 试剂(略)
6.3 产品参数的检测
6.3.1 外观(感官)的测定
取少量样品放到白色搪瓷盘(或白色塑料调色板)中,仔细观察样品的颜色、形状、质地。
6.3.2 有效活菌数的测定
采用平板计数法,根据所测微生物的种类选用适宜的培养基。
若采用最大可能数(Most Probable Number,MPN)5管法,遵照附录C的规定。
6.3.2.1 系列稀释
称取样品10 g(精确到0.01 g),加入带玻璃珠的100 mL的无菌水中(液体菌剂取l0.0 mL加入90 mL的无菌水中),静置20 min,在旋转式摇床上200 r/min充分振荡30 min,即成母液菌悬液(基础液)。
用无菌移液管分别吸取5.0mL上述母液菌悬液加入45 mL无菌水中,按1:10进行系列稀释,分别得到1:1×101,1:1×102,1:1×103,1:1×104……稀释的菌悬液(每个稀释度应更换无菌移液管)。
6.3.2.2 加样及培养
每个样品取3个连续适宜的稀释度,用无菌移液管分别吸取不同稀释度菌悬液0.1 mL,加至预先制备好的固体培养基平板上,分别用无菌玻璃刮刀将不同稀释度的菌悬液均匀地涂于琼脂表面。
每一稀释度重复3次,同时以无菌水作空白对照,于适宜的条件下培养。
6.3.2.3 菌落识别
根据所检测菌种的技术资料,每个稀释度取不同类型的代表菌落通过涂片、染色、镜检等技术手段确认有效菌。当空白对照培养皿出现菌落数时,检测结果无效,应重做。
6.3.2.4 菌落计数
以出现20~300个菌落数的稀释度的平板为计数标准(丝状真菌为10~150个菌落数),分别统计有效活菌数目和杂菌数目。当只有一个稀释度,其平均菌落数在20~300个之间时,则以该平均菌落数计算。若有两个稀释度,其平均菌落数均在20~300个之间时,应按两者菌落总数之比值决定。若其比值小于等于2应计算两者的平均数;若大于2则以稀释度小的菌落平均数计算。有效活菌数按式(1)或式(2)计算:
nm = kv1/(m0v2) ×10-8 …………………(1)
nv = kv1/(v0v2) ×10-8 …………………(2)
式中:
nm — 质量有效活菌数, 亿/g
nv — 体积有效活菌数, 亿/mL
— 菌落平均数, 个
k — 稀释倍数
v1 — 基础液体积, mL
v2 — 菌悬液加入量, mL
v0 — 样品量, mL
m0 — 样品量, g
6.3.3 霉菌杂菌数的测定
采用马丁培养基,测定方法同6.3.2。
6.3.4 杂菌率的测定
除样品有效菌外其它的菌均为杂菌。样品中杂菌率按式(3)计算:
m = n1/(n1+n)×100 …………………(3)
式中:
m — 样品杂菌率, %
n1 — 杂菌数, 亿/g(mL)
n — 有效活菌数, 亿/g(mL)
6.3.5 水分的测定
将空铝盒置于干燥箱中105 ℃±2 ℃烘干 0.5 h,冷却后称量记录空铝盒的质量。然后称取2份平行样品(颗粒型样品,应先粉碎过1.0 mm试验筛),每份20 g(精确到0.01 g),分别加入铝盒中并记录质量。将装好样品的铝盒置于干燥箱中105 ℃±2 ℃下烘干4 h~6 h。取出置于干燥器中冷却20 min后进行称量。水分含量按式(4)计算(结果为两次测定的平均值):
w = (m1- m2)/( m1- m0) ×100 …………………(4)
式中:
w — 样品水分含量, %
m0 — 空铝盒的质量, g
m1 — 样品和铝盒的质量, g
m2 — 烘干后样品和铝盒的质量, g
6.3.6 细度的测定
6.3.6.1 粉剂样品
称取样品50 g(精确到0.1 g),放入300 mL烧杯中,加200 mL水浸泡10 min~30 min后倒入孔径0.18 mm的试验筛中,然后用水冲洗,并用刷子轻轻地刷筛面上的样品,直至筛下流出清水为止。将试验筛连同筛上样品放入干燥箱中,在105 ℃±2 ℃烘干4 h ~6 h。冷却后称量筛上样品质量。样品细度按式(5)计算:
s ={1- m1/[ m0(1-w)]} ×100 …………………(5)
式中:
s — 筛下样品质量分数, %
m0 — 样品质量, g
w — 样品含水量, %
m1 — 筛上干样品质量, g
6.3.6.2 颗粒样品
称取样品50 g(精确到0.1 g),将两个不同孔径的试验筛(1.0 mm和4.75 mm)摞在一起放在底盘上(大孔径试验筛放在上面)。样品倒入大孔径试验筛内筛样品,然后称小孔径试验筛上的样品质量。颗粒细度按式(6)计算:
g = m1 /m0 ×100 …………………(6)
式中:
g — 样品质量分数, %
m1 — 小孔径试验筛上样品质量,g
m0 — 样 品 质 量, g
6.3.7 pH值的测定
打开酸度计电源预热30 min,用标准溶液校准。
pH值的测定,每个样品重复三次,计算三次的平均值。
6.3.7.1 液体样品
用量筒取40mL样品放入50 mL的烧杯中,直接用酸度计测定,仪器读数稳定后记录。
6.3.7.2 粉剂样品
称取样品15 g,放入50 mL的烧杯中,按1:2(样品:无离子水)的比例将无离子水加到烧杯中(如果样品含水量低,可根据基质类型按1:3~1:5的比例加无离子水),搅拌均匀。然后静置30 min,测样品悬液的pH值,仪器读数稳定后记录。
6.3.7.3 颗粒样品
样品先研碎过1.0 mm试验筛,按照6.3.7.2的方法测定。
6.3.8 粪大肠菌群数的测定
应符合GB/T 19524.1《肥料中粪大肠菌群的测定》的规定。
6.3.9 蛔虫卵死亡率的测定
应符合GB/T 19524.2《肥料中蛔虫卵死亡率的测定》的规定。
6.3.10 纤维素酶活、蛋白酶活的测定
应符合附录D的规定。
6.3.11 砷、镉、铅、铬、汞的测定
应符合GB 18877—2002中的5.12~5.17的规定。
6.3.12 保质期的检验
在产品说明书标明的保质期前,按6.3.1~6.3.11方法测定产品相应指标。
7 检验规则
本标准中产品技术指标的数字修约应符合GB 8170的规定;产品质量合格判定应符合GB 1250中修约值比较法的规定。
7.1 抽样
按每一发酵罐菌液(或每批固体发酵)加工成的产品为一批,进行抽样检验,抽样过程严格避免杂菌污染。
7.1.1 抽样工具
无菌塑料袋(瓶),金属勺、抽样器、量筒、牛皮纸袋、胶水、抽样封条及抽样单等。
7.1.2 抽样方法和数量
一般在成品库中抽样,采用随机法抽取。
抽样以件为单位,小包装以每一包装箱为一件。随机抽取3~5件,每件中随机抽取一袋(瓶);若每袋(瓶)包装小于500 g(mL)的产品,应多抽几件。大包装产品以一袋(桶)为一件,随机抽取5~10件,在无菌条件下,每件取样500 g(mL),然后将抽取样品混匀,按四分法分装3袋(瓶),每袋(瓶)不少于500 g(mL)。
7.2 检验分类(略)
7.3 判定规则
7.3.1 具下列任何一条款者,均为合格产品
a. 检验结果各项技术指标均符合标准要求的产品;
b. 在产品的外观、水分、细度、pH值等检测项目中,有1项不符合要求,而其它各项技术指标符合要求的产品。
7.3.2 具下列任何一条款者,均为不合格产品
a. 有效活菌数不符合技术指标;
b. 霉菌杂菌数不符合技术指标;
c. 杂菌率不符合技术指标;
d. 粪大肠菌群不符合技术指标;
e. 蛔虫卵死亡率不符合技术指标;
f. 砷、镉、铅、铬、汞中任一含量不符合技术指标;
g. 有机物料腐熟剂产品中所测酶活不符合技术指标;
h. 在外观、水分、细度、pH值等检测项目中,有2项(含)以上不符合要求。
8 包装、标识、运输和贮存
参见NY 885-2004《农用微生物产品标识要求》
附 录 A 常用检测培养基
参见NY/T 1114-2004《微生物肥料实验用培养基技术条件》
附 录 B
(资料性附录)
常用染色剂
B.1 革兰氏染色剂
B.1.1 结晶紫染色液(Hucker氏配方)
甲液:结晶紫(Crystal violet) 2.0 g
乙醇(95%) 20.0 mL
乙液:草酸铵[(NH4)2C2O4•H2O] 0.8g
蒸馏水 80.0 mL
甲、乙两液相混,过滤,棕色瓶保存。
B.1.2 卢哥(Lugol)氏碘液
碘(I2)片 1.0 g
碘化钾(KI) 2.0 g
蒸馏水 300 mL
先溶碘化钾于少量蒸馏水中,再将碘溶于碘化钾溶液中,可稍加热,最后加足蒸馏水,棕色瓶保存。
B.1.3 脱色液 95%的乙醇液。
B.1.4 复染液 0.5%的番红水溶液(Safranin O)
2.5%的番红酒精溶液 20 mL
蒸馏水 80 mL
B.2 芽胞染色液
B.2.1 孔雀绿染色液(Malachite green)
孔雀绿 5.0 g
蒸馏水 100 mL
B.2.2 0.5%番红染色液
B.3 石碳酸复红染色液
甲液:碱性复红(Basic fuchsin) 0.3 g
95%酒精 10.0 mL
乙液:石碳酸(Phenoecrystals C.P) 5.0 g
蒸馏水 95 mL
将甲、乙两液混合后即得石碳酸复红染色液原液。染色时,将原液稀释5~10倍使用。
附 录 C
(规范性附录)
稀释法(MPN 5管法)
C.1 稀释
称取样品10.0 g,加入带玻璃珠的100 mL的无菌水中(液体菌剂取l0.0 mL加入90 mL的无菌水中),静置20 min,在旋转式摇床上200 r/min充分振荡30 min,即得到1×101稀释度的菌悬液。
用无菌移液管吸取5.0mL上述菌悬液加入到装有45mL无菌水的三角瓶中,充分振荡摇匀,得到1×102稀释度的菌悬液,依此方法制成1×103、1×104、1×105……稀释度的菌悬液(每个稀释度应更换无菌移液管)。
C.2 加样
选择适宜的5个连续稀释度,用无菌移液管分别吸取不同稀释度的菌悬液1.0 mL,加到已准备好的盛有9.0 mL无菌培养基的螺口试管中,每一稀释度重复接5支试管(不同稀释度间更换无菌移液管),同时用无菌培养液作对照。
C.3 培养
接种后立即拧紧塑料帽并摇匀,将接种好的试管放到适宜的条件下培养。
C.4 计算
根据各稀释系列试管中有无待测微生物生长或其生理反应的正或负得出数量指标,并在相应的MPN统计表中查出近似值(见表C1),即可计算出待测样品的有效活菌数,以亿个/mL或亿个/g表示。
计算方法:
1mL(g)样品中的有效活菌数=菌数近似值×数量指标第一位数的稀释倍数
C.5 计数规则
在稀释系列中必须最后一个稀释度所有重复间都没有微生物生长。确定数量指标系取稀释系列中所有重复都有生长(或是正反应)的最高稀释度为数量指标的第一位数字,总共取三个连续稀释管的结果查表。
C.5.1 在全部5支试管中均出现生长的稀释度中,把出现生长的稀释度倍数最高的那一级放入数列。例如:为5-5-3-0-0时,则取5-3-0数列;
C.5.2 在全部5支试管中均不出现生长的稀释度中,把稀释度倍数最低的那一级放入数列。例如:为5-3-0-0-0时,则取5-3-0数列;
C.5.3 如果应用上述两条规则,会出现采用如5-5-4-3-0这样的4个等级的稀释度的情况。此时,可先取前面的5-4-3数列,后取4-3-0数列,分别求出lgMPN,然后算出其真数的平均值。在此列中,数列5-4-3的lgMPN为1.447,数列4-3-0的lgMPN为0.431+1(后一数列与前一数列相应稀释了10倍,故要加1进行校正),(1.447+1.431)/2=1.439,所以MPN=27.5。